散歩中、坂道の道路の脇に融雪剤を見つけました!
昨日は雪ちらついてたし、そういう準備大事ですよね!
ここで使われる塩化カルシウム。
なぜこれで雪が融けるか・・・。
というところを化学的に解説します!
知ってる人はゴメンね。
通常の状態(1気圧)においては、水の融点(凝固点)は知っての通り0℃です。
言い換えると、0℃以下では水は氷として存在します。
しかしながら、それは純粋な水ならばという話です。
例えば食塩水は0℃では凍りません。
何度で凍るかは溶液の濃度によってかわります。
化学では、水溶液が純粋な水に対して凝固点が低くなる現象を凝固点降下と呼びます。
これについては
△t=Km(Kは定数)
という式で習います。
ここで△tを凝固点降下度と呼び、mは質量モル濃度といいます。
凝固点降下度が高いほど、凝固点が低くなります。(ややこしいね)
例えば凝固点降下度が1なら凝固点はマイナス1度
凝固点降下度が2なら凝固点はマイナス2度
のようになるわけです。
式からわかるように凝固点降下度はmの値に依存します。
mが大きいほど凝固点降下度が大きくなり、凝固点がより低くなるということです。
ここでmは質量モル濃度と書きましたが、大事なのはこのときのモル数が粒子のモル数であることです。
(そもそも質量モル濃度というのは、溶媒1kgに、物質を何モル溶かしたか?という数値です。)
例えば砂糖(スクロース)を1kgの水に1モル溶かすとm=1mol/kgとなります。
砂糖は非電解質で、溶液中でイオンにわかれない物質です。
食塩(塩化ナトリウム)を同様に1kgの水に1モル溶かした場合
塩化ナトリウムは水中で電離してナトリウムイオンと塩化物イオンにわかれます。
つまり粒子が2倍になるわけです。
ということで、砂糖と同じ1モル溶かしたのに、m=2mol/kgとなるわけです。
ということは同じ1モル溶かした場合で、凝固点降下は食塩は砂糖の2倍となるわけです。
では、写真のように道路に置いている融雪剤がなぜ塩化カルシウムなのか・・・。
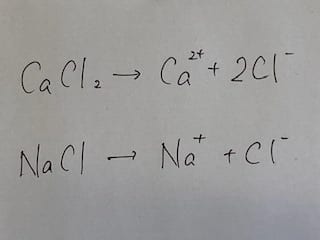
塩化カルシウムは上の式のように電離し、3つの粒子にわかれます。
食塩(塩化ナトリウム)は下の式のように電離し、2つの粒子にわかれます。
そうです!
塩化カルシウムを水1kgに1モル溶かした場合、m=3mol/kg
となるわけです。つまり凝固点降下は砂糖の3倍、食塩の1.5倍となるわけです。
融雪剤・・・。
なんとなく雪を解かす薬品みたいなイメージだったと思いますが
実は上記のように、塩化カルシウムを使うことで、雪(水)の凝固点を効率よく下げ、それによって氷が水になる現象を利用しているんです!すごいですね!
化学は身近なところにころがっています!
知識を得ることでより楽しくなる科目です!
こんな感じで、ボクが知ってることは、いつも塾生に話しまくっています!
(時々調子に乗りすぎますが・・・。)
化学は本当におもしろい!
君もウチで、ボクと化学を勉強してみないか!?

